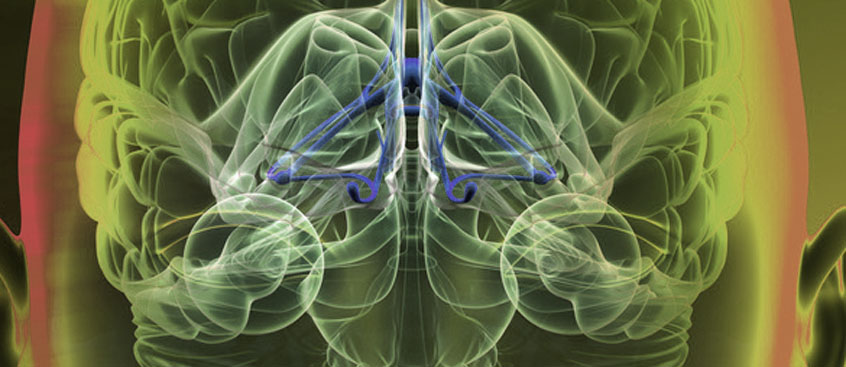
Datos de RM presentados en la 61 reunión anual de la AAN demuestran que NATALIZUMAB fomenta remielinización
Datos adicionales sugieren mejoría en pacientes tratados con natalizumab a través de los resultados clínicos y reportados por pacientes. Seattle, Washington – 28 de abril de 2009 – Biogen Idec (NASDAQ: BIIB) y Elan Corporation, plc (NYSE: ELN) anunciaron hoy los resultados de un estudio que demuestra que natalizumab fomenta la regeneración y la estabilización de los daños causados a la vaina de mielina, medida por resonancia magnética de tecnología avanzada.
El daño a la vaina de mielina provoca los síntomas de la esclerosis múltiple (EM). También serán presentados pósters adicionales durante el Congreso destacando la capacidad de natalizumab, en algunos pacientes, para mejorar la función física y los resultados reportados por pacientes sobre la cognición, la calidad de vida, y la fatiga.
Natalizumab es la primera terapia aprobada para la EM cuyos datos reportados sugieren que algunos de los signos de progresión de la enfermedad se pueden detener.
El robusto perfil de eficacia demostrado en ensayos clínicos es mejorado aún más a partir de estos datos y puede ayudar a redefinir el éxito en la EM.
«Lo que hemos visto en estos datos de RM sugieren que natalizumab puede tener la capacidad para reparar y restaurar posiblemente algunos de los daños de la vaina de mielina que protege las fibras nerviosas. Los resultados de este estudio apoyan la continuación de las investigaciones de los efectos potenciales de natalizumab en este proceso «, dijo Robert Zivadinov, MD, del Instituto de Neurología Jacobs en Buffalo, Nueva York, el principal investigador para el estudio remielización.
«Natalizumab está cambiando la forma de definir el éxito en el tratamiento de la EM de neurólogos y pacientes «, dijo Michael Panzara, MD, MPH, Vicepresidente y Jefe médico de neurología, Biogen Idec. «Estos datos de RM que se presentarán en la AAN proporcionan evidencia precoz que parece indicar que natalizumab puede no sólo frenar el progreso de la EM, sino también puede ser capaz de revertir los daños causados por la enfermedad.»
«Todos los días, más pacientes entienden que natalizumab puede representar una nueva forma de ver – y manejar – su enfermedad», afirmó Carlos Payá, MD, Ph.D., presidente, Elan Corporation. «Estos últimos análisis se construyen sobre los más impresionantes datos que hemos visto hasta la fecha con natalizumab».
Natalizumab ayudó a estabilizar y restaurar los daños a la vaina mielina
El estudio de imágenes, que incluía un total de 110 sujetos, utiliza una avanzada tecnología de resonancia magnética denominada Voxel Wise MTR para medir las lesiones y el tejido cerebral normal. El estudio demostró que natalizumab promovió remielización en comparación con aquellos que recibieron interferón beta-1a IM y controles normales.
El efecto de natalizumab en lesiones y parénquima cerebral aparentemente normal (NABT ) en EM con recaídas se evaluó con el método de imágen Voxel-Wise (VW) utilizando el método de ratio de transferencia de magnetización (RTM). RTMVW es reconocido como un poderoso instrumento para el seguimiento de la actividad de la EM y la eficacia de las intervenciones terapéuticas en pacientes con EM.
En el estudio, 62 pacientes con EM que recibieron natalizumab fueron seguidos durante 12 meses junto con 26 pacientes con EM que recibieron interferón beta-1a IM y 22 controles normales ajustados en edad y sexo. Para cada sujeto, se colocaron mapas de volumen MTR basales y de seguimiento en un espacio común – medio. El mapa resultante VW de sustracción fue realzado a través del algoritmo de mejoría de cluster umbral libre (TFCE) , y un umbral significativo se determinó basándose en una simulación Monte Carlo. Se cuantificaron volúmenes supra-umbral (95a percentil) para las áreas de aumento (remielinizada) y de disminución (desmielinizada) de voxels MTR examinados, que representan un valor de volumen.
No hubo una diferencia significativa en la disminución del volumen RTMVW NABT durante el seguimiento entre los tratados con natalizumab y los grupos de control normal. Se observó un mayor potencial de remielización en pacientes con EM remitente-recidivante en ambas terapias y menor evidencia de desmielinización en pacientes con EM secundaria progresiva. con recaídas El volumen de cambios en RTMVW NABT (disminución o aumento) fue casi 3-5 veces superior a la cantidad de cambios observados en el volumen de la lesión T2. Esto indica que el RTMVW podría ser un método mucho más sensible para captar cambios de desmielinización / remielización en el tiempo, que las mediciones basadas en lesiones de volumen.
El póster describiendo el estudio:» Natalizumab Promotes Remyelination in Patients with Multiple Sclerosis. A Voxel-Wise Magnetization Transfer Imaging Case-Control Study (P03.071)» está disponible para su visualización, el martes 28 de abril de 2009, a las 4:00 pm PDT.
Natalizumab aumentó significativamente la probabilidad acumulada de lograr una mejora sostenida de la discapacidad en pacientes con EM con recaídas.
El póster describiendo el estudio:» Sustained Improvement in Physical Disability with Natalizumab in Patients with Relapsing Multiple Sclerosis (P06.131)» está disponible para su visualización, el Miércoles 29 de abril de 2009, a las 4:00 p.m. PDT.
Los datos de este análisis post-hoc han sido presentados en el Congreso Mundial de 2008 sobre Tratamiento y la Investigación de la Esclerosis Múltiple. Los datos mostraron que natalizumab produce resultados significativos en la probabilidad acumulada de una mejora sostenida de la discapacidad física en pacientes tratados durante más de dos años en comparación con placebo. En pacientes con una puntuación basal en la escala expandida del estado de discapacidad (EDSS) de = 2.0, el tratamiento con natalizumab aumentó significativamente la probabilidad de una mejora sostenida de la discapacidad en un 69 por ciento en relación con placebo. En los mismos pacientes, la probabilidad de lograr una mejora sostenida fue 29,6 por ciento con natalizumab (n = 417) en comparación con el 18,7 por ciento con placebo (n = 203) (p = 0,006). En pacientes con una puntuación EDSS = 2.0 y con enfermedad muy activa al inicio del estudio, la diferencia entre los grupos fue aún mayor, el 35,5 por ciento para natalizumab (n = 103) y el 15,4 por ciento para el placebo (n = 40) (p = 0,045).
Estudio de Criterios de Valoración Reportados por los Pacientes
En este estudio, a pacientes con EM RR se les pidió después de tres meses de tratamiento que puntuaran su de mejora, utilizando instrumentos de valoración validados. El póster presentado en AAN muestra que, en general, los pacientes informaron de mejoras significativas en la función cognitiva, la calidad de vida general y específica de la enfermedad relacionada con la salud, y bajos niveles de fatiga después de la tercera perfusión de natalizumab. El estudio longitudinal de un año evalúa los resultados de salud desde la perspectiva del paciente antes de comenzar con natalizumab y en fechas posteriores predeterminadas.
Uno de los pósters,» Early Effects of Natalizumab on Patient Reported Fatigue and Cognitive Function (P02.142) «se puso a disposición para su visualización el martes, 28 de abril a las 11:30 am PDT y un segundo póster, «Change in Health-Related Quality of Life in Multiple Sclerosis Patients Receiving Natalizumab (P05.144)» estará disponible para su visualización el miércoles, 29 de abril de 2009, a las 11:30 am PDT.
Acerca de natalizumab
Natalizumab es un tratamiento aprobado para las formas recidivantes de EM en los Estados Unidos y EM remitente-recidivante en la Unión Europea. Según los datos publicados en el New England Journal of Medicine, después de dos años, el tratamiento con Natalizumab llevó a una reducción relativa del 68% (p <0,001) en la tasa anual de recaídas en comparación con placebo y redujo el riesgo relativo de progresión de la discapacidad en 42-54% (p <0,001).
Natalizumab fue aprobado recientemente en los EE.UU. para inducir y mantener la respuesta clínica y remisión en pacientes adultos con enfermedad de Crohn (EC) moderada a severamente activa con evidencias de inflamación que han tenido una respuesta inadecuada a, o son incapaces de tolerar, terapias convencionales para EC y los inhibidores de TNF – Alfa. De acuerdo con la información de prescripción de los EE.UU., los pacientes que respondieron a Natalizumab, el 54% mantienen su respuesta a través de cada visita por un año en comparación con el 20% de los pacientes que recibieron placebo (p <0,001), por una diferencia de tratamiento del 34%.
Natalizumab aumenta el riesgo de leucoencefalopatía multifocal progresiva (LMP), una infección viral oportunista del cerebro que conduce generalmente a la muerte o a la discapacidad severa. Han sido reportados casos de LMP en pacientes recibiendo Natalizumab, que fueron tratados recientemente o tratados concomitantemente con inmunosupresores o inmunomoduladores, así como en pacientes que recibieron Natalizumab como monoterapia. Otras reacciones adversas serias que han ocurrido en pacientes tratados con Natalizumab incluyen reacciones de hipersensibilidad (por ejemplo, anafilaxis) e infecciones. Infecciones oportunistas y atípicas han sido observadas en pacientes tratados con Natalizumab, algunos de los cuales estaban recibiendo inmunosupresores concomitantemente. Las infecciones por herpes fueron ligeramente más comunes en pacientes tratados con Natalizumab. En los ensayos clínicos en EM y EC, la incidencia y la tasa de otras reacciones adversas graves y comunes, incluyendo incidencia global y tasa de infecciones, fueron similares entre los pacientes con Natalizumab y aquellos que recibían placebo. Las reacciones adversas comunmente reportadas en pacientes tratados con Natalizumab incluyen dolor de cabeza, fatiga, reacciones a la infusión, infecciones del tracto urinario, dolor en las extremidades, y erupción cutánea. Otras reacciones adversas reportadas en pacientes con EC tratados con Natalizumab incluyen infecciones de las vías respiratorias y náuseas. Se ha comunicado daño hepático clínicamente significativo en pacientes tratados con Natalizumab en la post-comercialización.
Natalizumab ha sido aprobado en más de 40 países. Biogen Idec y Elan Corporation, plc (NYSE: ELN) tienen una asociación de 50-50 para el desarrollo y promoción de Natalizumab. Biogen Idec